Одноатомные спирты, их физические и химические свойства himzakaz.net
26-04-2017
Спирты – это отдельный класс органических соединений, которые в своем составе содержат одну или несколько гидроксильных группу. В зависимости от количества групп ОН эти кислородсодержащие соединения делятся на одноатомные спирты, трехатомные и т.д. Чаще всего эти сложные вещества рассматривают как производные углеводородов, молекулы которых претерпели изменения, т.к. один или несколько атомов водорода заместились на гидроксильную группу.
Я кстати куплю спирт оптом, долго искал надежного поставщика и нашел, проект himzakaz.net , рекомендую!

Наиболее простыми представителями данного класса являются одноатомные спирты, общая формула которых выглядит так: R-OH или Cn+ H 2n+1OH.
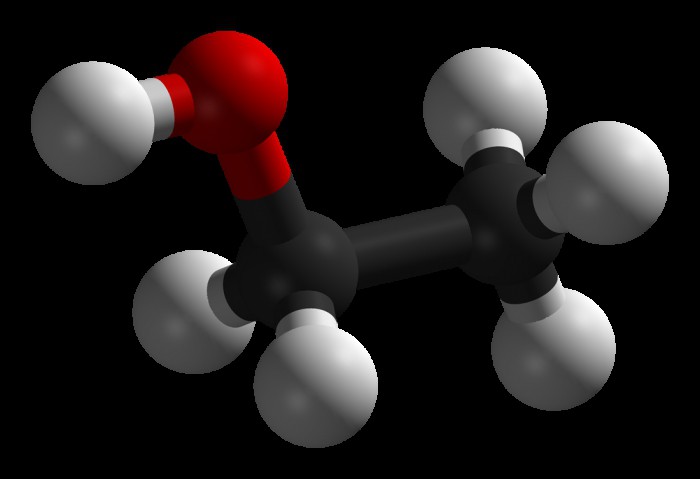
Гомологический ряд этих соединений начинается метиловым спиртом или метанолом (СН3ОН), вслед за которым идет этанол (С2Н5ОН), затем пропанол (С3Н7ОН) и т.д.
Для алкоголей характерна изомерия карбонового скелета и функциональной группы.
Одноатомные спирты проявляют такие физические свойства:
- Спирты, содержащие до 15 атомов углерода – жидкости, 15 и более – твердые вещества.
- Растворимость в воде зависит от молекулярной массы, чем она выше, тем спирт хуже растворяется воде. Так, низшие спирты (до пропанола) смешиваются с водой в любых пропорциях, а высшие практически не растворимы в ней.
- Температура кипения также возрастает с увеличением атомной массы, например, t кип. СН3ОН= 65 °С, а t кип. С2Н5ОН =78 °С.
- Чем выше температура кипения, тем ниже летучесть, т.е. вещество плохо испаряется.
Данные физические свойства насыщенных спиртов с одной гидроксильной группой можно объяснить возникновением межмолекулярной водородной связи между отдельными молекулами самого соединения или спирта и воды.
Одноатомные спирты способны вступать в такие химические реакции:
- Горение - пламя светлое, выделяется тепло: С2Н5ОН + 3О2 – 2СО2+2Н2О.
- Замещение – взаимодействие алканолов с активными металлами, продуктами реакции являются нестойкие соединения - алкоголяты, - способные разлагаться водой: 2С2Н5ОН+ 2К – 2С2Н5ОК +Н2.
- Взаимодействие с галогеноводородными кислотами: С2Н5ОН + HBr - С2Н5Br+Н2О.
- Эстерификация с органическими и неорганическими кислотами, в результате которой образуется эфир.
- Окисление, при котором получаются альдегиды или кетоны.
- Дегидратация. Данная реакция происходит при нагревании с помощью катализатора. Внутримолекулярная дегидратация у низших спиртов происходит по правилу Зайцева, итогом данной реакции является образование воды и ненасыщенного углеводорода. При межмолекулярной дегидратации продуктами реакции будут простые эфиры и вода.
Рассмотрев химические свойства алкоголей, можно сделать вывод, что одноатомные спирты – это амфотерные соединения, т.к. они могут реагировать с щелочными металлами, проявляя слабые кислотные свойства, и с галогенводородами, проявляя основные свойства. Все химические реакции идут с разрывом связи О-Н или С-О.
Таким образом, предельные одноатомные спирты – это сложные соединения с одной группой ОН, не имеющие свободных валентностей после образования связи С-С и проявляющие слабо свойства и кислот, и оснований. За счет своих физических и химических свойств они нашли широкое применение в органическом синтезе, в производстве растворителей, добавок к топливу, а также в пищевой промышленности, медицине, косметологии (этанол)
Продажа медицинского этилового спирта http://himzakaz.net/ .
- Вконтакте
- YouTube

